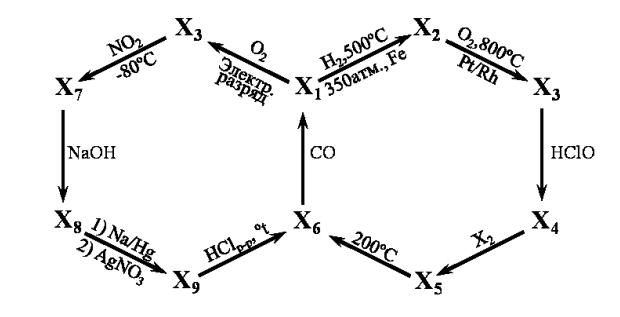
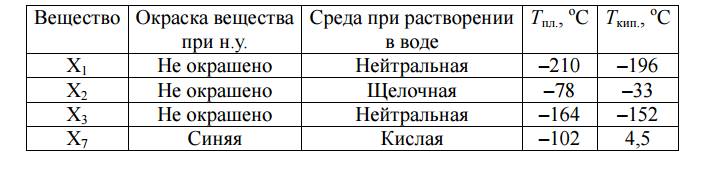
![]() — некоторый минерал. В тексте задания в скобках приведены номера химических реакций.
— некоторый минерал. В тексте задания в скобках приведены номера химических реакций.
1,00 г вещества ![]() добавили к избыточному количеству
добавили к избыточному количеству ![]() , после чего смесь нагревали в воздушной среде до тех пор, пока не произойдёт сплавление (1). Продукт реакции поместили в горячую воду (2, 3). В результате выпал осадок
, после чего смесь нагревали в воздушной среде до тех пор, пока не произойдёт сплавление (1). Продукт реакции поместили в горячую воду (2, 3). В результате выпал осадок ![]() бурого цвета. Осадок пропустили через фильтр и нагрели до 500 °С (4). Получили красное вещество
бурого цвета. Осадок пропустили через фильтр и нагрели до 500 °С (4). Получили красное вещество ![]() массой 0,46 г. Жидкость, оставшуюся после фильтрования осадка
массой 0,46 г. Жидкость, оставшуюся после фильтрования осадка ![]() , перелили в отдельный стакан и пропустили через неё углекислый газ (5). Выпал осадок
, перелили в отдельный стакан и пропустили через неё углекислый газ (5). Выпал осадок ![]() , при прокаливании образующий 0,59 г осадка
, при прокаливании образующий 0,59 г осадка ![]() . Известно, что интенсивное прокаливание смеси веществ
. Известно, что интенсивное прокаливание смеси веществ ![]() и
и ![]() приведёт к образованию
приведёт к образованию ![]() (7). При взаимодействии
(7). При взаимодействии ![]() с концентрированной серной кислотой происходит «вскрытие» минерала (8).
с концентрированной серной кислотой происходит «вскрытие» минерала (8).
Вопросы:
- Какова формула минерала
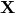 ?
? - Напишите уравнения реакций 1 – 8.