Известно, что соединения ![]() содержат в составе один и тот же элемент.
содержат в составе один и тот же элемент.
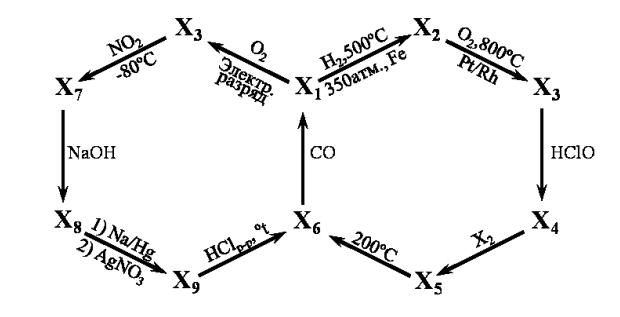
Для некоторых веществ даны их свойства:
1) Определите молекулярные формулы и названия веществ ![]() .
.
2) Напишите уравнения реакций, изображённых на схеме.
Известно, что соединения ![]() содержат в составе один и тот же элемент.
содержат в составе один и тот же элемент.

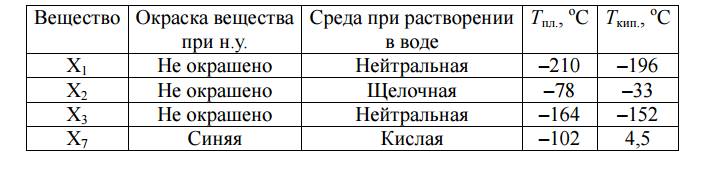
Для некоторых веществ даны их свойства:

1) Определите молекулярные формулы и названия веществ ![]() .
.
2) Напишите уравнения реакций, изображённых на схеме.
Тема занятий в субботу, 1 октября, — определение формулы неизвестного вещества. Задачи становятся запутаннее, а «неизвестных» — больше.
Неорганические вещества и
реагируют в соотношении 1:1 с образованием в качестве единственного продукта вещества
, имеющего молярную массу 100 г/моль. При реакции 1 моль
с 3 моль
образуется 2 моль
и эквимолярная смесь двух солей
и
, молярные массы которых отличаются на 100 г/моль. Определите вещества
,
и
. Ответ подтвердите расчётом.
Белое твёрдое вещество растворяется в воде с образованием кислого раствора. При взаимодействии
с концентрированной
происходит выделение газа с молярной массой 20 г/моль, содержащего элемент
. Определите вещество
, если известно, что массовая доля элемента
в нём равна 48,7 %. Почему раствор
в воде имеет кислую среду?
(водный р-р)
Список заданий будет пополняться, последнее обновление было в 2:20 30 сентября 2016.
На занятиях в субботу, 1 октября, продолжим решать задачи на определение формулы веществ из сборника «Стандартные алгоритмы решения нестандартных химических задач».
На занятии в субботу, 24 сентября, начнём с первого типа задач — на нахождение неизвестной формулы вещества. Потренируемся на задачах этапов Всероссийской и Московской олимпиад, Турнира Ломоносова и сборника «Стандартные алгоритмы решения нестандартных химических задач».